توصلت دراسة حديثة إلى أن العلماء تمكنوا من تحديد التغيُّرات التي تطرأ على الحمض النووي للأشخاص المصابين بالورم الأرومي الدبقي متعدد الأشكال، ما من شأنه أن يمكنهم من التنبؤ بكيفية نمو هذا الورم الدماغي العدائي، الذي تسبَّب في موت السيناتور الأميركي جون ماكين.
ورغم تطور علاجات مرض السرطان، فإن الورم الأرومي الدبقي ما زال يحيّر الأطباء ويقتل نصف المرضى المصابين به في غضون سنة فقط من ظهوره.
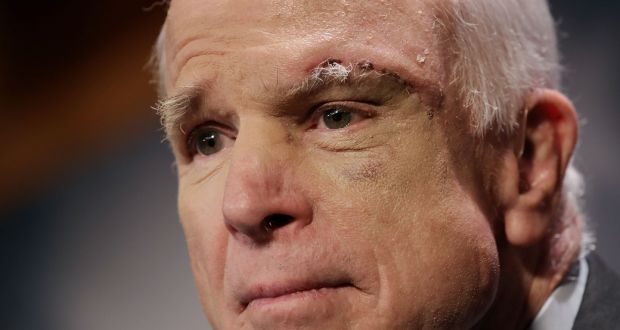
المرض العضال تمكن من إنهاء حياة السيناتور جون ماكين في 25 أغسطس/آب 2018، وذلك بعد سنة واحدة فقط من اكتشاف إصابته بهذا الورم. ويمكن القول إن علاج هذه الأورام الأرومية الدبقة بشكل جزئي صعب للغاية، نظراً لكونها تتحول بسرعة، وتتخذ نمطاً مقاوماً للعلاج.
لكن، تمكنت مجموعة من الباحثين في فيينا من تحديد أنماط التغيرات الجينية التي قد تسمح بالتنبؤ بمسار نمو السرطان، من خلال القيام باختبار بسيط فقط.
يختار الخلايا الأقدر على مقاومة العلاج فيتكاثر بسرعة
تودي الأورام الدماغية بحياة 13 ألف مواطن أميركي في السنة الواحدة. ويعتبر الورم الأرومي الدبقي متعدد الأشكال أحد أفتك هذه الأورام وأصعبها عند العلاج. ويعمل العلماء على تطوير علاجات تسمح بتحديد هذه الأورام ومهاجمتها بصفة محدّدة، إلا أن مثل هذه التوجهات أثبتت فشلها على مدار العقد الماضي.
ويرجع سبب هذا الفشل إلى كون هذه الأورام تتكون في الأساس من عدة أنواع مختلفة من الخلايا.
ويمكن لمرض السرطان "اختيار" الخلايا القادرة على تحمل العلاج بشكل أفضل لتُواصل التكاثر خارج نطاق السيطرة، في حين يصبح تكاثر الخلايا القابلة للعلاج أبطأ. ويدفعنا ذلك لاستنتاج أن العلماء يسعون للتعامل مع هدف متحرك أثناء محاولتهم تطوير علاجات جديدة أو استخدام العلاجات المتاحة.
لذا هو أكثر تعقيداً من سائر الأورام
يدرك العلماء أن الأشخاص يرثون إلى حدٍّ ما سمات وخصائص الحمض النووي، على غرار الجينات التي تتسبب في نمو الورم بشكل أسرع، أو نقص الجينات التي تساهم في التصدي للأورام. ويبدو أن الورم الأرومي الدبقي متعدد الأشكال أكثر تعقيداً من الجينات الوراثية.
فيما يتعلق بالدراسة الجديدة التي نُشرت في صحيفة Nature Medicine، نظر الباحثون في مركز أبحاث الطب الجزيئي "CeMM" التابع للأكاديمية النمساوية للعلوم إلى علم التَّخَلُّق، أو ما يعرف بالطريقة التي تعرضت فيها الجينات للإيقاف والتشغيل من طرف الورم الأرومي الدبقي متعدد الأشكال.
ودرس العلماء مثيلية أو methylation الحمض النووي، أي إضافة المجموعات الجزيئية إلى أجزاء من الحمض النووي. ويمكن لمجموعة الميثيل التي انتقلت إلى الحمض النووي أن تصبح نشيطة، وبالتالي يفعّل الحمض النووي أجزاء مختلفة من الشيفرة الوراثية.
ويتسبَّب بتغييرات تخلقية بالدماغ نفسه
وقد فحص العلماء هذه الأنماط لدى أكثر من 200 مريض نمساوي مصاب بهذا الورم الخبيث، ليتبيّن أن أدمغة المرضى شهدت بعض التغييرات التخلقية، التي كانت مرتبطة بدورها بمسار نمو الورم الدبقي، وحتى بالمدة التي تمكن خلالها المريض من الصمود والبقاء على قيد الحياة.
وتضمَّنت هذه التغيرات التخلقية اختيار الخلايا المقاومة للعلاج، ومنحت الباحثين رؤى جديدة حول كيفية تكوّن هذه الأورام، وهو ما سيساعدهم على تطوير علاجات أفضل.
تنبؤ تطور الورم يساعد الأطباء عرقلة نموه
وقد أفادت الباحثة الرئيسية في هذه الدراسة، جوانا كلوغامر، وهي طالبة دكتوراه في مركز أبحاث الطب الجزيئي، التي أشرفت على تحليل البيانات لصحيفة Daily Mail البريطانية أنه "يمكن اعتماد تسلسل مثيلة الحمض النووي كاختبار واحد للتنبؤ، بمجموعة واسعة من خصائص الورم ذات الصلة سريرياً".
ومن شأن هذه التجارب أن تمنح الأطباء السريريين والباحثين "نهجاً جديداً لاستخدامه في تحديد عدم التجانس في الأورام الدماغية"، وفقاً لكلوغامر، وهو ما سيمكنهم من التنبؤ بكيفية مقاومة الأورام الأرومية الدبقية للعلاج.
الأورام تتغذى من الدم وقطع هذا الرافد الخطوة الأولى نحو القضاء عليها
في الأثناء، توصل فريق من الباحثين في جامعة بنسيلفانيا الأميركية إلى معرفة طرق أخرى ممكنة لعرقلة نمو السرطان، وفقاً لدراسة أخرى نُشرت في 27 أغسطس/آب. في الواقع، تحتاج الأورام إلى التغذية عن طريق الدم الذي يحمل الأكسجين والمواد الغذائية، وذلك من أجل نموها.
وتطمح مجموعة من العقاقير المستخدمة لعلاج الورم الأرومي الدبقي متعدد الأشكال إلى قطع تدفق الدم إلى الورم، ولكن ذلك لا يبدو كافياً لإطالة مدة بقاء المرضى على قيد الحياة.
مع ذلك، وخلال التجارب التي أجراها الباحثون في جامعة بنسيلفانيا على الفئران، عمد الفريق إلى استهداف الخلايا داخل الأوعية الدموية التي يمكن للورم التأثير عليها وإفسادها، لجعلها مقاومة للعلاج. وبمجرد إزالة خطر هذه الخلايا وتعطيلها، سيصبح الورم نفسه عرضة لهجمات العلاج.